ACCEDE A LA SIMULACIÓN EN PANTALLA COMPLETA
28 de octubre de 2015
Simulación: Calculos quimicos EL MOL (Leyes fundamentales)
Accede a la siguiente animación, que puedes usar a pantalla completa en el siguiente enlace, para trabajar cálculos químicos con EL MOL (moléculas, g, L, etc.).
ACCEDE A LA SIMULACIÓN EN PANTALLA COMPLETA
ACCEDE A LA SIMULACIÓN EN PANTALLA COMPLETA
25 de octubre de 2015
Medidas de cantidades en Química: masa atómica. masa molecular, mol, masa molar, masa fórmula y volumen molar
Masa atómica y masa molecular
Se define la unidad de masa atómica, u, como la doceava parte de la masa de un átomo de Carbono-12.
En la tabla periódica se recoge una masa atómica promedio, que es la masa ponderada de sus masas isotópicas.
Cantidad de sustancia. El mol
Se utiliza el mol como una unidad fundamental en las reacciones químicas. Se define como la cantidad de sustancia que contiene tantas entidades (átomos, moléculas, iones, electrones...) como átomos hay en 12 g del isótopo de C-12. Es decir, un mol de átomos tiene una masa en gramos igual a la masa atómica de dicho átomo. Y un mol de moléculas (o de unidades fórmula) contiene la masa en gramos de la masa molecular (o masa fórmula). Por ello, un mol contiene 6,022·1023 entidades (átomos, moléculas....).
Masa molar y masa fórmula
A la masa de un mol de sustancia se le denomina masa molar, y se expresa en g/mol.
Relación entre masa-cantidad de sustancia
Volumen molar
Se denomina volumen molar al volumen que ocupa 1 mol de una determinada sustancia. En el caso de gases, y en condiciones normales (c.n.), ese volumen es 22,414 L. (c.n. son 0 ºC y 1 atmósfera de presión).
Se define la unidad de masa atómica, u, como la doceava parte de la masa de un átomo de Carbono-12.
En la tabla periódica se recoge una masa atómica promedio, que es la masa ponderada de sus masas isotópicas.
Cuando un compuesto está formado por moléculas, hablamos de masa molecular, que es la suma de las masas atómicas de los átomos que forman la molécula.
Así, la masa molecular del agua, H2O, será Mr= 1,01·2 + 16,00·1= 18,02 (que no tiene unidades, al ser una masa molecular relativa).
Cantidad de sustancia. El mol
Se utiliza el mol como una unidad fundamental en las reacciones químicas. Se define como la cantidad de sustancia que contiene tantas entidades (átomos, moléculas, iones, electrones...) como átomos hay en 12 g del isótopo de C-12. Es decir, un mol de átomos tiene una masa en gramos igual a la masa atómica de dicho átomo. Y un mol de moléculas (o de unidades fórmula) contiene la masa en gramos de la masa molecular (o masa fórmula). Por ello, un mol contiene 6,022·1023 entidades (átomos, moléculas....).
Masa molar y masa fórmula
A la masa de un mol de sustancia se le denomina masa molar, y se expresa en g/mol.
En el caso de sustancias con enlace iónico o metálico, formados por redes cristalinas, o sustancias covalente formadas por redes cristalinas covalentes, no podemos hablar de masa molecular, sino de masa fórmula.
 |
| Red cristalina iónica de NaCl Masa fórmula M= 58,44 |
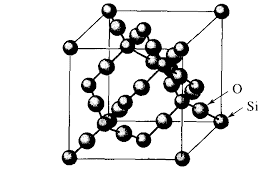 |
| Red cristlina covalente de SIO2 Masa fórmula, M= 60,09 |
Relación entre masa-cantidad de sustancia
La masa, m, la cantidad de sustancia, n, y el número de entidades elementales, N, están relacioandas como se indica a continuación, donde NA representa el número de Avogadro,
6,022·1023y M, la masa molar de la sustancia.
Se denomina volumen molar al volumen que ocupa 1 mol de una determinada sustancia. En el caso de gases, y en condiciones normales (c.n.), ese volumen es 22,414 L. (c.n. son 0 ºC y 1 atmósfera de presión).
Leyes volumétricas: Ley de volúmenes de combinación e Hipótesis (Ley) de Avogrado
Hemos estudiado las relaciones entre las masas que se combinan (leyes ponderales). Pero, ¿qué podemos decir si consideramos otra magnitud muy importante, como es el volumen, y, además las reacciones son entre gases?
Así, en 1808, el químico francés Gay Lussac estableció de forma experimental la ley volumétrica, o ley de los volúmenes de combinación.
 Esta ley, sin embago, parecía contradecir la teoría atómica de Dalton. Por ejmplo, según Dalton, la fórmula del agua sería HO. Pero según Gay Lussac, no, sería H2O, según la explicación del gráfico.
Esta ley, sin embago, parecía contradecir la teoría atómica de Dalton. Por ejmplo, según Dalton, la fórmula del agua sería HO. Pero según Gay Lussac, no, sería H2O, según la explicación del gráfico.
Avogadro fue quien finalmente logró encajar esta ley en la teoría de Dalton, al enunciar la conocida como hipótesis de Avogadro:
- Volúmenes iguales de gases diferentes, en las mismas condiciones de p y T, contienen el mismo número de moléculas.
- Las partículas de los gases elementales no son átomos, sino agregados de dos o más átomos, llamados moléculas.
La síntesis de estas dos hipótesis es lo que conocemos como ley de Avogadro.
Teoría atómica de Dalton (en formato flash)
Puedes estudiar la Teoría atómica de Dalton gracias a la animación del IES Aguilar y Cano, de Sevilla.
Vídeo: Leyes ponderales de la Química
En este vídeo, un profesor (de CostaRica) explica las Leyes ponderales de la Química.
18 de octubre de 2015
Divulgación. Libro original de John Dalton (parte I y II): A new system of chemical philosophy
Esta es la obra original de Dalton, partes I y II. Puedes encontrar:
a) Hipótesis manejadas por Dalton para explicar las relaciones ponderales (cap. III, pág. 211)
b) Alusiones a Gay-Lussac y a la ley de los volúmenes de combinación (págs. 556 y siguientes)
c) Valores manejados por Dalton referentes a la masa relativa entre oxígeno e hidrógeno (págs. 270-276
d) Interpretación de las sustancias gaseosas.
1. Leyes fundamentales de la Química (Documentación)
Puedes descargar la presentación de diapositivas de la unidad 1, Leyes fundamentales de la Química.
Etiquetas:
1.Leyes fundametales,
Dalton,
Documentación,
Fórmula química,
Lavoisier,
Leyes fundamentales de la Química,
mol,
Proust
1. Leyes ponderales: Actividades de aprendizaje Nº 1 (unidad 1)
A6.- El amoniaco es un compuesto formado por Hidrógeno y Nitrógeno. Al analizar varias muestras, se han obtenido los siguientes resultados:
Verificar la ley de las proporciones definidas.
¿Cuánto Nitrógeno se combina con 1 gramo de Hidrógeno?
¿Cuánto amoniaco se formará a partir de ese hidrógeno y nitrógeno? ¿Qué ley aplicas?
A7.- El cloro y el sodio se combinan para dar cloruro de sodio en la siguiente relación: 71 gramos de cloro con 46 gramos de sodio. Calcula:
a) La cantidad necesaria de sodio para que se combine totalmente con 30 gramos de cloro.
b) Si se ponen a reaccionar 50 gramos de cloro y 80 gramos de sodio, ¿qué sustancia queda en exceso y en qué cantidad? ¿Cuánto cloruro de sodio se formará?
A8.- El azufre y el oxígeno forman tres compuestos distintos en proporciones diferentes:
Compuesto 1. Se combina 32 g de S con 16 gramos de O
Compuesto 2. Se combina 32 g de S con 32 gramos de O
Compuesto 3. Se combina 32 g de S con 48 gramos de O
Verificar la ley de las proporciones múltiples
A9.- Supongamos que reaccionan dos elementos (X e Y) y que las relaciones de sus masas combinadas son:
A la vista de estos datos, di si las siguientes afirmaciones son verdaderas:
A11.- Se ha comprobado experimentalmente que 4,7 g del elemento A reaccionan por completo con 12,8 g del elemento B para originar 17,5 g de cierto compuesto. ¿Qué cantidad de compuesto se formará si hacemos reaccionar 4,7 g de A con 11,5gdeB? Solución: 15,7 g
A12.- El azufre y el cinc se combinan en la relación 16 g de azufre y 32,7 g de cinc. ¿Qué cantidad de sulfuro de cinc se obtendrá al combinar químicamente 20 g de azufre con 20 g de cinc?
A13.- El estaño puede formar con el oxígeno dos tipos de óxidos: en el óxido A, la proporción en masa entre el estaño y el oxígeno es 7,42:1, y en el óxido B, 3,71:1.
a) ¿Se cumple la ley de las proporciones múltiples?
b) Si el óxido A se compone de un átomo de Sn y otro de O indica la composición del óxido B
A14.- Ejercicio de aplicación:
En una prospección minera obtenemos dos muestras de mineral de hierro que, tras ser analizadas, dan los siguientes resultados: una de las muestras, A, de 15 g, contiene 10,49 g de hierro y 4,51 g de oxígeno, y la otra muestra, B, de 20 g, contiene 14,47 g de hierro y 5,53 de oxígeno. Determina si se trata del mismo mineral en ambos casos.
Pautas para resolverlo: 1º Comprensión. 2º Datos. 3º Resolución. 4º Comprobación o verificación - Los datos de las reacciones 1 y 3 justifican la ley de Proust.
- Los datos de las reacciones 1, 2 y 4 justifican la ley de las proporciones múltiples.
- Los compuestos formados en las reacciones 1 y 2 son iguales.
- Los compuestos formados en las reacciones 1 y 3 son iguales.
- Muestra A: 39,563 g de Sn y 5,333 g de O.
- Muestra B: 29,673 g de Sn y 4,000 g de O.
A11.- Se ha comprobado experimentalmente que 4,7 g del elemento A reaccionan por completo con 12,8 g del elemento B para originar 17,5 g de cierto compuesto. ¿Qué cantidad de compuesto se formará si hacemos reaccionar 4,7 g de A con 11,5gdeB? Solución: 15,7 g
A12.- El azufre y el cinc se combinan en la relación 16 g de azufre y 32,7 g de cinc. ¿Qué cantidad de sulfuro de cinc se obtendrá al combinar químicamente 20 g de azufre con 20 g de cinc?
A13.- El estaño puede formar con el oxígeno dos tipos de óxidos: en el óxido A, la proporción en masa entre el estaño y el oxígeno es 7,42:1, y en el óxido B, 3,71:1.
a) ¿Se cumple la ley de las proporciones múltiples?
b) Si el óxido A se compone de un átomo de Sn y otro de O indica la composición del óxido B
A14.- Ejercicio de aplicación:
En una prospección minera obtenemos dos muestras de mineral de hierro que, tras ser analizadas, dan los siguientes resultados: una de las muestras, A, de 15 g, contiene 10,49 g de hierro y 4,51 g de oxígeno, y la otra muestra, B, de 20 g, contiene 14,47 g de hierro y 5,53 de oxígeno. Determina si se trata del mismo mineral en ambos casos.
Solución: se trata de compuestos diferentes.
Leyes fundamentales de la Química: Actividades de aprendizaje previas
Criterio de evaluación: Interpretar la teoría atómica de Dalton y las leyes ponderales asociadas a su formulación para explicar algunas de las propiedades de la materia; utilizar la ecuación de estado de los gases ideales para relacionar la presión el volumen y la temperatura, calcular masas y formulas moleculares.
LO QUE DEBES APRENDER:
1. Justifica la teoría atómica de Dalton y la discontinuidad de la materia a partir de las leyes fundamentales de la Química ejemplificándolo con reacciones.
2. Determina las magnitudes que definen el estado de un gas aplicando la ecuación de estado de los gases ideales.
3. Explica razonadamente la utilidad y las limitaciones de la hipótesis del gas ideal.
4. Determina presiones totales y parciales de los gases de una mezcla relacionando la presión total de un sistema con la fracción molar y la ecuación de estado de los gases ideales.
5. Relaciona la fórmula empírica y molecular de un compuesto con su composición centesimal aplicando la ecuación de estado de los gases ideales.
6. Calcula la masa atómica de un elemento a partir de los datos espectrométricos obtenidos para los diferentes isótopos del mismo.
7. Describe las aplicaciones de la espectroscopía en la identificación de elementos y compuestos.
1. Justifica la teoría atómica de Dalton y la discontinuidad de la materia a partir de las leyes fundamentales de la Química ejemplificándolo con reacciones.
2. Determina las magnitudes que definen el estado de un gas aplicando la ecuación de estado de los gases ideales.
3. Explica razonadamente la utilidad y las limitaciones de la hipótesis del gas ideal.
4. Determina presiones totales y parciales de los gases de una mezcla relacionando la presión total de un sistema con la fracción molar y la ecuación de estado de los gases ideales.
5. Relaciona la fórmula empírica y molecular de un compuesto con su composición centesimal aplicando la ecuación de estado de los gases ideales.
6. Calcula la masa atómica de un elemento a partir de los datos espectrométricos obtenidos para los diferentes isótopos del mismo.
7. Describe las aplicaciones de la espectroscopía en la identificación de elementos y compuestos.
REFLEXIONES Y ACTIVIDADES DE APRENDIZAJE PREVIAS
A1.- Haz un esquema de la clasificación de la materia, a partir de su clasificación en mezclas y sustancias puras, y que contenga al menos los siguientes términos; sustancias simples (elementos), mezclas homogéneas, mezclas heterogéneas, disoluciones, compuestos, separación por métodos físicos, separación por métodos químicos....
A2.- La exactitud y la precisión en las medidas experimentales son características del trabajo en los laboratorios. ¿Qué leyes se pudieron establecer en relación a las masas de sustancias químicas cuando las medidas alcanzaron dichas caracterticas?
A3.- En su momento, la teoría atómica de Dalton tuvo como principal éxito la justificación de las leyes ponderales.
a) ¿Podrías describir los postulados de la teoría atómica de Dalton?
b) ¿Crees que la teoría está vigente hoy en día?
A4.- El concepto de mol ha sido fundamental en el desarrollo de la química moderna. Su definición está ligada a la denominada constante de Avogadro de valor 6,022·1023.
a) ¿Sabrías nombrar esta cantidad? ¿Crees que existirá un número así de insectos en la Tierra?
b) ¿Sabes qué expresa la constante o número de Avogadro?
A5.- Las leyes experimentales de los gases describen su comportamiento respecto a las variaciones de la presión, el volumen y la temperatura.
a) ¿Eres capaz de explicar estos comportamientos mediante la teoría cinético-molecular de la materia?
b) ¿Sabrías expresar la ley de Boyle y las dos leyes de Charles y Gay-Lussac de los gases ideales?
16 de octubre de 2015
Unidad 1.- Leyes fundamentales de la Química
Relación de contenidos y apuntes de la Unidad:
1.-
Clasificación de la materia
- Sustancias puras y mezclas
- Métodos físicos de separación
2.-
Estudio de la reacciones químicas. Leyes ponderales
- Ley de conservación de la masa
- Ley de las proporciones definidas
- Ley de las proporciones múltiples
3.-
Teoría atómica de Dalton
- Interpretación de las leyes ponderales
- Limitaciones de la teoría
4.-
Ley de los volúmenes de combinación de Gay-Lussac
- Ley de Avogadro
- Interpretación de las reacciones entre gases: teoría atómico-molecular
5.-
Medida de cantidades en Química
- Masa atómica y masa molecular, relativas: masa atómtica promedio, masa molecular, masa fórmula, número de Avogadro
- La cantidad de sustancia: el mol.
- Masa molar y masa-fórmula
- Relación entre masa-cantidad de sustancia
- Volumen molar
6.-
Fórmulas químicas: cálculos
- Composición centesimal
- Determinación de fórmulas empíricas y moleculares
7.-
Los gases
- Teoría cinético-molecular de los gases
- Las leyes de los gases
- Ecuación de estado de los gases ideales. Gases reales.
- Mezcla de gases: ley de las presiones parciales
8.-
Técnicas espectroscópicas de análisis químico
- Interacción entre luz y materia (espectro electromagnético)
- Espectroscopia atómica
- Espectroscopía IR
4 de octubre de 2015
Unidad inicial. Recursos sobre medida de magnitudes
A la hora de expresar el resultado de una medida, ya sea directa o indirectamente, debes saber:
- Múltiplos y submúltiplos
- Uso de la notación científica.
- Cifras signitficativas. Uso y redondeo de cifras significativas.
- Cambio de unidades mediante factores de conversión.
Documentación unidad inicial: estrategias para la resolución de problemas y gráficas
Puedes acceder a la siguiente documentación:
- Apuntes de la unidad inicial
- Estrategias para la resolución de problemas: factores de conversión, análisis dimensional, representaciones gráficas y cálculo de errores.
- Más sobre estrategias para la resolución de problemas: cálculo de erorres absoluto y relativo en las medidas.
- Análisis de datos: tablas y gráficas.
3 de octubre de 2015
Profundización: El péndulo de Foucault
El péndulo de Foucault, ideado por el físico francés Jean Bernard-Leon Foucault en 1851, constituye un elegante experimento que demuestra la rotación de la Tierra. Foucault suspendió en el Panteón de París un cuerpo de 28 kg de peso y 67 m de longitud.
Observa estos videos sobre dicho experimento. En el segundo video, unos alumnos diseñaron un experimento que explica cómo dos observadores distintos ven de diferente manera el movimiento del péndulo.
Además, podrás entender cómo construir uno casero, accediendo al siguiente enlace:
CONSTRUYE UN PÉNDULO DE FOUCAULT CASERO
Además, podrás entender cómo construir uno casero, accediendo al siguiente enlace:
CONSTRUYE UN PÉNDULO DE FOUCAULT CASERO
Unidad inicial: Actividades de aprendizaje
Puedes decargar las hojas de ejercicios de las actividades de aprendizaje:
Actividades de aprendizaje Unidad inicial (Hoja Nº 1)
Actividades de aprendizaje Unidad inicial (Hoja Nº 2)
Actividades de aprendizaje Unidad inicial (Hoja Nº 1)
Actividades de aprendizaje Unidad inicial (Hoja Nº 2)
Simulación: variables que influyen en el período de oscilación de un péndulo
En la siguiente animación podrás recrear la investigación de la variables que influyen en el período de un péndulo: masa, ángulo de lanzamiento y longitud.
Recursos: Variables que influyen en el período de oscilación de un péndulo
Accede a la siguiente presentación de diapositivas para que tengas claro cómo ha de hacerse la investigación:
Puedes descargar los dos archivos siguientes como ejemplo de la investigación. Se trata del trabajo de un alumno:
Trabajo de investigación de un alumno (archivo 1)
Trabajo de investigación de un alumno (archivo 2)
Puedes descargar los dos archivos siguientes como ejemplo de la investigación. Se trata del trabajo de un alumno:
Trabajo de investigación de un alumno (archivo 1)
Trabajo de investigación de un alumno (archivo 2)
Unidad inicial.- El trabajo científico. Generalidades
Esta unidad inicial se estructura en las siguientes actividades:
- El Método Científico: Investigación experimental de las variables que influyen en el período de un péndulo.
- Magnitudes y unidades:
- Tipos de ma de magnitudes. Magnitudes escalares y vectoriales
- Sistema Internacional de Unidades.
- Notación científica. Cambio de unidades (factores de conversión). Cifras significativas.
- Análisis dimensional: Cuadro de dimensiones de las magnitudes fundamentales y de magnitudes derivadas.
- Medida de magnitudes y errores:
- Instrumentos de medida: Sensibilidad y resolución
- Medidas directas e indirectas
- Errores de medida: sistemáticos y aleatorios, relativo y absoluto. (el péndulo)
- Expresión numérica de la medida
-
Análisis de datos: Tablas y gráficos.
- Ejercicios y ejemplos: bosón de Higgs.
- Propuesta de investigación.
APUNTES: Puedes descargarte el archivo de los apuntes
2 de octubre de 2015
Divulgación: Mujeres en la Luz y en las Tecnologías de la Luz
El 20 de diciembre de 2013 la Asamblea General de las
Naciones Unidas 2015 como "Año Internacional de la Luz y de las
Tecnologías basadas en la Luz" (luz2015.es)
para poner de manifiesto el papel fundamental que desempeñan la luz y
sus tecnologías en todas las actividades humanas. Basta mirar a nuestro
alrededor para comprobar que las numerosas aplicaciones de la luz han
revolucionado la sociedad a través de la ciencia, la ingeniería, la
arquitectura, la medicina, la energía, las comunicaciones, la
astronomía, la cultura, el arte o el ocio.
Dos de los objetivos de esta declaración son “promocionar el
empoderamiento de la mujer en la Ciencia” y “fomentar vocaciones
científicas en el ámbito de la luz y de sus aplicaciones”. Con esas dos
motivaciones, un grupo de personas pertenecientes al Grupo de Mujeres en
Física de la Real Sociedad Española de Física (RSEF) y a la Sociedad
Española de Óptica (SEDOPTICA) hemos estado trabajando para visibilizar
investigadoras que han contribuido significativamente al desarrollo del
campo científico de la luz y a ellas hemos dedicado esta Exposición de
“Investigadoras en la Luz y en las Tecnologías de la Luz”. Además, es
indudable que dando visibilidad a la labor de estas científicas y
poniendo en valor sus aportaciones en el avance de las tecnologías
ópticas y fotónicas de nuestra Sociedad, crearemos referentes para las
futuras generaciones y, sobre todo, para las jóvenes estudiantes.
Investigadoras en la Luz y en las Tecnologías de la Luz from Augusto Beléndez (UA) on Vimeo.
Unidad inicial. Proyecto de investigación: ¿De qué variables depende el período de oscilación de un péndulo?
Suscribirse a:
Entradas (Atom)







