Masa atómica y masa molecular
Se define la unidad de masa atómica, u, como la doceava parte de la masa de un átomo de Carbono-12.
En la tabla periódica se recoge una masa atómica promedio, que es la masa ponderada de sus masas isotópicas.
Cuando un compuesto está formado por moléculas, hablamos de masa molecular, que es la suma de las masas atómicas de los átomos que forman la molécula.
Así, la masa molecular del agua, H2O, será Mr= 1,01·2 + 16,00·1= 18,02 (que no tiene unidades, al ser una masa molecular relativa).
Cantidad de sustancia. El mol
Se utiliza el mol como una unidad fundamental en las reacciones químicas. Se define como la cantidad de sustancia que contiene tantas entidades (átomos, moléculas, iones, electrones...) como átomos hay en 12 g del isótopo de C-12. Es decir, un mol de átomos tiene una masa en gramos igual a la masa atómica de dicho átomo. Y un mol de moléculas (o de unidades fórmula) contiene la masa en gramos de la masa molecular (o masa fórmula). Por ello, un mol contiene 6,022·1023
entidades (átomos, moléculas....).
Masa molar y masa fórmula
A la masa de un mol de sustancia se le denomina masa molar, y se expresa en g/mol.
En el caso de sustancias con enlace iónico o metálico, formados por redes cristalinas, o sustancias covalente formadas por redes cristalinas covalentes, no podemos hablar de masa molecular, sino de masa fórmula.
 |
Red cristalina iónica de NaCl
Masa fórmula M= 58,44 |
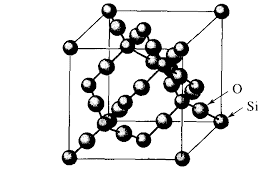 |
Red cristlina covalente de SIO2
Masa fórmula, M= 60,09 |
Relación entre masa-cantidad de sustancia
La masa, m, la cantidad de sustancia, n, y el número de entidades elementales, N, están relacioandas como se indica a continuación, donde NA representa el número de Avogadro,
6,022·1023y M, la masa molar de la sustancia.
Volumen molar
Se denomina volumen molar al volumen que ocupa 1 mol de una determinada sustancia. En el caso de gases, y en condiciones normales (c.n.), ese volumen es 22,414 L. (c.n. son 0 ºC y 1 atmósfera de presión).